
วันเสาร์ที่ 15 กรกฎาคม พ.ศ. 2560
วันพุธที่ 12 กรกฎาคม พ.ศ. 2560
บทที่ 3 สมบัติของธาตุและสารประกอบ
บทที่ 3 สมบัติของธาตุและสารประกอบ
สมบัติของสารประกอบของธาตุตามคาบ
- สมบัติของสารประกอบคลอไรด์ของธาตุในคาบ 2 และ 3
สารประกอบดลอไรด์
คุณสมบัติ |
สารประกอบคลอไรด์ของโลหะ
|
สารประกอบคลอไรด์ของอโลหะ
|
จุดเดือด
|
สูง
|
ต่ำ
|
จุดหลอมเหลว
|
สูง
|
ต่ำ
|
ความเป็นกรด-เบสของสารละลาย
|
กลาง
ยกเว้นBeCl2 และ NaCl3 ซึ่งป็นกรด |
กรด
|
สารที่ไม่ละลายน้ำ
|
CCl4 NCl5
|
-
|
- สมบัติของสารประกอบออกไซด์ของธาตุในคาบ 2 และ 3
สารประกอบออกไซด์
คุณสมบัติ |
สารประกอบออกไซด์ของโลหะ
|
สารประกอบออกไซด์ของอโลหะ
|
จุดเดือด
|
สูง
|
ต่ำ
|
จุดหลอมเหลว
|
สูง
|
ต่ำ
|
ความเป็นกรด-เบสของสารละลาย
|
เบส
|
กรด
|
สารที่ไม่ละลายน้ำ
|
BeO Al3O3
|
SiO2
|
สมบัติของธาตุแต่ละหมู่
ธาตุหมู่ I โลหะอัลคาไลน์
1. มีเวเลนส์อิเล็กตรอนเท่ากับ 1
2. มีเลขออกซิเดชัน +1
3. ทำปฏิกิริยาได้ดีมาก จึงไม่พบโลหะหมู่ I ในธรรมชาติ แต่จะพบในสารประกอบ สารประกอบทุกตัวเป็นพันธะไอออนิก
4. สารประกอบของโลหะหมู่ I ละลายน้ำได้ทุกตัว
5. ทำปฏิกิริยารุนแรงกับน้ำ ได้ด้างและแก๊ส H2
6. ความหนาแน่นต่ำ ลอยน้ำได้ จุดเดือด จุดหลอมเหลว ไม่สูงนัก
<อ่านเพิ่มเติม>
วันอังคารที่ 11 กรกฎาคม พ.ศ. 2560
บทที่ 2 พันธะเคมี
บทที่ 2 พันธะเคมี
ชนิดของพันธะเคมี
พันธะภายในโมเลกุล
(intramolecular bond)
พันธะระหว่างโมเลกุล
(intermolecular bond)
พันธะโคเวเลนต์ (covalent bonds)
พันธะไฮโดรเจน (hydrogen bonds)
พันธะไอออนิก (ionic bonds)
แรงแวนเดอร์วาลส์ (Van der Waals forces)
พันธะโลหะ ( metallic bonds)
แรงดึงดูดระหว่างโมเลกุล - ไอออน
(molecule-ion attractions)
พันธะไอออนิก
พันธะไอออนิก ( Ionic bond ) หมายถึงแรงยึดเหนี่ยวที่เกิดในสารประกอบที่เกิดขึ้นระหว่าง 2 อะตอมอะตอมที่มีค่าอิเล็กโตรเนกาติวิตีต่างกันมาก อะตอมที่มีค่าอิเลคโตรเนกาติวิตีน้อยจะให้อิเลคตรอนแก่อะตอมที่มีค่าอิเลคโตรเนกาติวิตีมาก และทำให้อิเล็กตรอนที่อยู่รอบๆ อะตอมครบ 8 (octat rule ) กลายเป็นไอออนบวก และไอออนลบตามลำดับ เกิดแรงดึงดูดทางไฟฟ้าระหว่างไอออนบวกและไอออนลบ และเกิดเป็นโมเลกุลขึ้น เช่น การเกิดสารประกอบ NaCl ดังภาพ
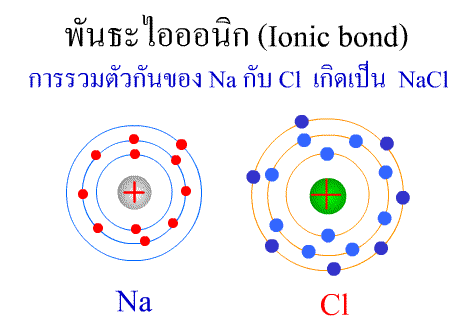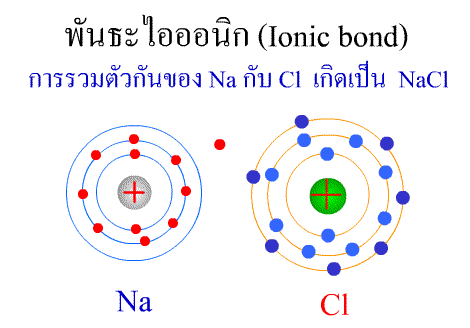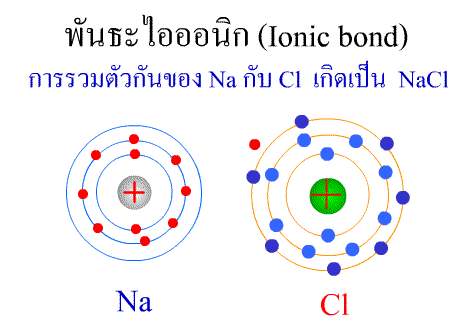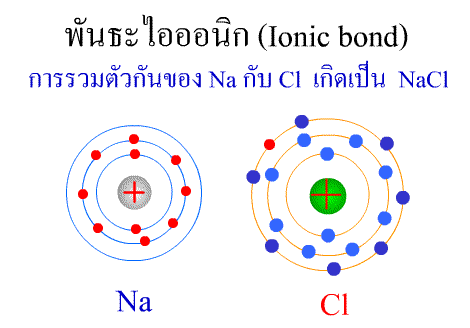
พันธะภายในโมเลกุล
(intramolecular bond) |
พันธะระหว่างโมเลกุล
(intermolecular bond) |
พันธะโคเวเลนต์ (covalent bonds)
|
พันธะไฮโดรเจน (hydrogen bonds)
|
พันธะไอออนิก (ionic bonds)
|
แรงแวนเดอร์วาลส์ (Van der Waals forces)
|
พันธะโลหะ ( metallic bonds)
|
แรงดึงดูดระหว่างโมเลกุล - ไอออน
(molecule-ion attractions) |
พันธะไอออนิก
พันธะไอออนิก ( Ionic bond ) หมายถึงแรงยึดเหนี่ยวที่เกิดในสารประกอบที่เกิดขึ้นระหว่าง 2 อะตอมอะตอมที่มีค่าอิเล็กโตรเนกาติวิตีต่างกันมาก อะตอมที่มีค่าอิเลคโตรเนกาติวิตีน้อยจะให้อิเลคตรอนแก่อะตอมที่มีค่าอิเลคโตรเนกาติวิตีมาก และทำให้อิเล็กตรอนที่อยู่รอบๆ อะตอมครบ 8 (octat rule ) กลายเป็นไอออนบวก และไอออนลบตามลำดับ เกิดแรงดึงดูดทางไฟฟ้าระหว่างไอออนบวกและไอออนลบ และเกิดเป็นโมเลกุลขึ้น เช่น การเกิดสารประกอบ NaCl ดังภาพ

วันอาทิตย์ที่ 9 กรกฎาคม พ.ศ. 2560
บทที่ 1 อะตอมและตารางธาตุ
บทที่ 1 อะตอมและตารางธาตุ

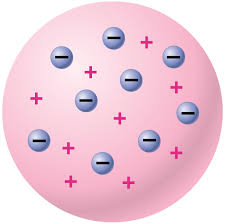
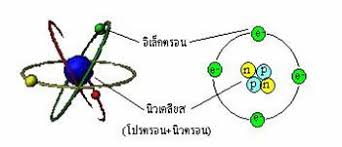
อะตอม คือหน่วยที่เล็กที่สุดของสสารที่ยังคงสภาพความเป็นสสารอยู่ได้
แบบจำลองอะตอม ตามทฤษฏี มีอยู่ 5 แบบ คือ
1. แบบจำลองอะตอมของดอลตัน
สสารทุกชนิดประกอบด้วยอนุภาคที่เล็กที่สุดเรียกว่า อะตอม
ซึ่งไม่สามารถแบ่งแยกต่อไปได้อีก
2.แบบจำลองอะตอมของทอมสัน
-ค้นพบอิเล็กตรอน ที่ มีประจุไฟฟ้าลบ มีมวลประมาณ1/2000 ของมวลของ H
-โดยศึกษาพฤติกรรมของ หลอดรังสีแคโทด ในสนามแม่เหล็กไฟฟ้า
3. แบบจำลองของรัทเทอร์ฟอร์ด
การกระเจิง (scattering) ของอนุภาค a โดยแผ่นทองคำบางๆ
รัทเทอร์ฟอร์ดพบว่ารังสีส่วนใหญ่ไม่เบี่ยงเบน
และส่วนน้อยที่เบี่ยงเบนนั้น ทำมุมเบี่ยงเบนใหญ่มาก
บางส่วนยังเบี่ยงเบนกลับทิศทางเดิมด้วย จำนวนรังสีที่เบี่ยงเบนจะมากขึ้นถ้าความหนาแน่นของแผ่นโลหะเพิ่มขึ้น
สมัครสมาชิก:
ความคิดเห็น (Atom)
